Ötzis Schönheitsgeheimnis - Gefriergetrocknet für 5300 Jahre
Grund für die ungewöhnlich gute Konservierung scheint die jahrtausendelange Gefriertrocknung des Ötzi im Gletschereis zu sein. In ihrer neuesten Veröffentlichung präsentiert die Arbeitsgruppe von PD Dr. Robert Stark, Department für Geo- und Umweltwissenschaften der LMU und Mitglied des Exzellenzclusters Nanosystems Initiative Munich (NIM), Untersuchungen zum Aufbau einzelner Kollagenmoleküle, zur Struktur von Molekülbündeln, den Kollagenfasern, sowie deren Elastizität.
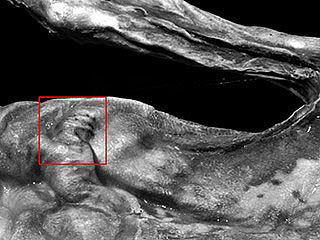
Während sich die oberste Hautschicht der Gletschermumie in den Jahrtausenden weitgehend zersetzt hat, sind die darunter liegenden Kollagenfasern des Bindegewebes nahezu unverändert erhalten geblieben. Drei 5 x 5 mm große Hautstücke der Mumie standen den Wissenschaftlern für ihre Tests zur Verfügung. Zum Vergleich untersuchten sie frisches Hautgewebe eines Mannes der etwa im gleichen Lebensalter war wie der Eismensch Ötzi.
Dabei richteten sie ihren Blick mit Hilfe eines Rasterkraftmikroskopes zunächst auf die äußere Struktur einzelner Kollagenfasern. Kollagen ist ein hierarchisch aufgebautes Protein, das aus drei ineinander verwundenen Tropokollagen-Molekülen besteht. Mehrere dieser rund 300 Nanometer (nm) langen Kollagenmoleküle bilden zusammen eine Kollagenfibrille. Die Kollagenmoleküle sind parallel leicht zueinander versetzt angeordnet wodurch ein charakteristisches, sich alle 67 nm wiederholendes Bänderungsmuster entsteht. Dieses Muster ließ sich sowohl im frischen Gewebe als auch in der Probe des Ötzi in identischer Form wiederfindet. Mittels Raman-Spektroskopie untersuchten die Wissenschaftler anschließend den Aufbau einzelner Kollagenmoleküle. Auch hier stimmten die Messergebnisse der frischen und der 5300 Jahre alten Proteine überein.
Einen Unterschied konnten die Wissenschaftler jedoch feststellen: Die Kollagenfasern der Mumie sind nicht mehr so elastisch wie die aus frischem Gewebe. Um diese Materialeigenschaft zu testen, drücken sie die knapp 50 nm dünne Spitze eines Rasterkraftmikroskopes mit einer definierten Kraft auf eine einzelne Faser und heben sie wieder ab. Die Tiefe des dabei entstehenden Abdruckes zeigt, wie elastisch das Testmaterial ist. Im Fall der Kollagenfasern des Eismenschen ergab sich ein Eindruck von 0,5 nm, bei den frischen Fasern waren es 0,7 nm. Die Wissenschaftler vermuten, dass die Austrocknung des Gewebes die Ursache für diese Versteifung ist. Denn frühere Arbeiten haben gezeigt, dass durch Dehydrierung neue Bindungen (Wasserstoffbrückenbindungen) zwischen Proteinen geknüpft werden, was die Elastizität der Fasern einschränkt.
Publikation
"Nanostructure and mechanics of mummified type I collagen from the 5300-year-old Tyrolean Iceman"
Marek Janko, Albert Zink, Alexander M. Gigler, Wolfgang M. Heckl, and Robert W. Stark
Proceedings of Royal Society B online, 31. März 2010
doi:10.1098/rspb.2010.0377
RSS-Feeds @ Archäologie Online
- Nachrichten
- Videos
- Podcasts